BS Vũ Đình Tuân
ĐẶT VẤN ĐỀ
Kỹ thuật ICSI ra đời là một phương pháp điều trị hiệu quả cho những cặp vợ chồng vô sinh, đặc biệt nguyên nhân do nam giới với tinh trùng rất ít, yếu kèm hình dạng bất thường cao hoặc tinh trùng thu nhận từ mào tinh, tinh hoàn. Tinh trùng tươi hoặc trữ đông sau khi lọc rửa được lựa chọn để tiêm vào trứng dựa trên hình thái và khả năng di động của chúng. Tuy nhiên, trong nhiều trường hợp, mẫu tinh trùng thu nhận được bất động hoàn toàn gây khó khăn cho việc lựa chọn này. Để cải thiện kết quả ICSI trong những trường hợp này, nhiều phương pháp đã được mô tả để lựa chọn tinh trùng bất động nhưng còn sống.
Phép thử HOS (Hypo-Osmotic Swelling test – phép thử sự trương phồng do áp suất thẩm thấu thấp) ban đầu được xem như một tiêu chí đánh giá về tỷ lệ sống của tinh trùng trên những mẫu tinh trùng hoàn toàn bất động, đã được WHO 2010 ghi nhận là phương pháp đánh giá tỷ lệ sống áp dụng rộng rãi cho các xét nghiệm tinh dịch đồ. Nhiều nghiên cứu chứng minh thử nghiệm HOS kết hợp với kỹ thuật ICSI giúp cải thiện đáng kể tỷ lệ thụ tinh ở những mẫu tinh trùng bất động hoàn toàn. Trong thử nghiệm HOS, việc lựa chọn tinh trùng sống biểu hiện ở sự xoắn đuôi của tinh trùng khi đưa vào môi trường nhược trương.
Trong bài báo cáo này, chúng tôi đánh giá kết quả ICSI kết hợp với thử nghiệm HOS trên tinh trùng có các dạng xoắn đuôi khác nhau trong môi trường nhược trương nhằm lựa chọn dạng trương phồng của tinh trùng đem lại hiệu quả ICSI tốt nhất.
MỤC TIÊU
Đánh giá kết quả thực hiện ICSI kết hợp HOS test với các dạng trương phồng khác nhau của tinh trùng, từ đó xác định dạng trương phồng tối ưu cho kỹ thuật ICSI.
TỔNG QUAN Y VĂN
ICSI ra đời năm 1992 ngay từ đầu đã tạo một bước đột phá cho một trung tâm lab-IVF nói riêng và ngành hỗ trợ sinh sản nói chung. Nó được xem như một quy trình thành công cho hỗ trợ sinh sản trong những trường hợp vô sinh do yếu và thất bại thụ tinh không rõ nguyên nhân (IVF cổ điển) (Palermo et al., 1992, 1993; Van Steirteghem et al., 1993).
Quy trình ICSI đòi hỏi chỉ cần tinh trùng sống không cần tính di động. Trong quá trình làm ICSI, tính di động được xem là quan trọng cho chọn lựa tinh trùng sống. Trong một số trường hợp, chỉ có tinh trùng bất động ở trong những mẫu tinh trùng tươi (từ xuất tinh hay thu nhận từ mào tinh, tinh hoàn) hay trữ đông. Tinh trùng sống có thể được xác định dựa trên nhuộm sống DNA hay tế bào chất. Tuy nhiên, quy trình nhuộm có thể tác động lên tính nguyên vẹn của DNA, khả năng tiếp xúc của giao tử hay quá trình hình thành phôi trong quá trình hỗ trợ sinh sản.
Một số phương pháp khác để xác định tinh trùng sống: thêm pentoxyfilline (Tasdemir và cộng sự, 1998; Tournaye và cộng sự, 1994; Rizk và cộng sự, 1995), kích thích cơ học (de Oliveira và cộng sự, 2004), kĩ thuật laser (Aktan và cộng sự, 2004). Tuy nhiên, toàn bộ những phương pháp này đều có khuyết điểm (de Oliveira và cộng sự, 2004; Verheyen và cộng sự, 1997; Jeyendran and Zaneveld, 1986; Jeyendran et al., 1992).
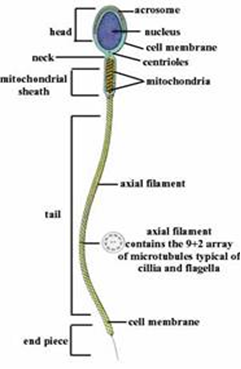
HOST (Hypo-Osmotic Swelling Test) được phát triển lần đầu như là giải pháp cho quá trình đánh giá tính toàn vẹn về chức năng của màng tinh trùng người. Tinh trùng được ủ trong môi trường nhược trương và những tinh trùng này có màng chức năng, trải qua quá trình trương phồng của khoảng không gian tế bào chất và những cấu trúc đuôi dạng sợi của tinh trùng bị xoắn lại. Những thay đổi này có thể quan sát dưới kính hiển vi. Tinh trùng không có màng bào tương hoạt động sẽ không có trương phồng tế bào chất và phần đuôi không bị xoắn. Tinh trùng có phản ứng HOS là tinh trùng sống có thể sử dụng để chích vào bào tương trứng trong những trường hợp asthenozoospermia, có thể cho kết quả thụ tinh cao hơn khi so sánh với trường hợp phải lựa chọn một cách ngẫu nhiên.
Những chứng cứ y văn về HOST
Nghiên cứu đầu tiên kỹ thuật HOS
R. S. Jeyendran, H. H. Van der Ven, M. Perez-Pelaez, B. G. Crabo and L. J. D. Zaneveld. “Phát triển một kĩ thuật đánh giá tính toàn vẹn chức năng của màng tinh trùng người và mối quan hệ của nó với những đặc điểm khác của tinh dịch.”
Tính toàn vẹn màng tinh trùng không chỉ quan trọng cho quá trình trao đổi chất của tinh trùng, mà sự thay đổi một cách chính xác về những tính chất của màng cần cho hợp nhất giữa giao tử đực và cái, ví dụ như quá trình hoạt hóa tinh trùng, phản ứng acrosome, quá trình kết hợp tinh trùng với bề mặt trứng. Vì vậy, tính nguyên vẹn và hoạt động chức năng của màng tinh trùng là một cơ bản cho quá trình thụ tinh, và đánh giá chức năng màng có thể là một chỉ thị cho khả năng thụ tinh của tinh trùng. Hiện tại không có những test nào thích hợp cho mục đích này. Những test trước đây chỉ thể hiện màng tinh trùng có nguyên vẹn về mặt hình thái hay không. Điều này giống như nhuộm sống chết bằng cách đo lường khả năng thuốc nhuộm eosin Y đi vào màng, một tín hiệu chứng tỏ rằng màng bị biến đổi về hình thái học do chấn thương tế bào hay tế bào bị chết. Vì vậy, phát triển kỹ thuật đo lường tính nguyên vẹn chức năng của màng tinh trùng rất có giá trị và có thể sẵn sàng ứng dụng lâm sàng.
Một tính chất của màng tế bào là khả năng cho phép quá trình vận chuyển phân tử một cách chọn lọc. Khi ủ trong điều kiện nhược trương, nước sẽ vào tinh trùng để cân bằng lại áp suất. Dòng chảy vào của nước sẽ tăng thể tích tinh trùng và màng bào tương sẽ căng phồng lên đưa tỉ lệ “bề mặt:thể tích” về nhỏ nhất. Đuôi tinh trùng cũng biến đổi một cách đặc biệt với những điều kiện nhược trương (hình 1). Những điều này cảm ứng những biến đổi trong hình thái của tinh trùng, có thể thấy được dưới KHV phản pha. Nói đơn giản, tác động căng lên như bong bóng sẽ được đề cập như là “sự trương phồng”.
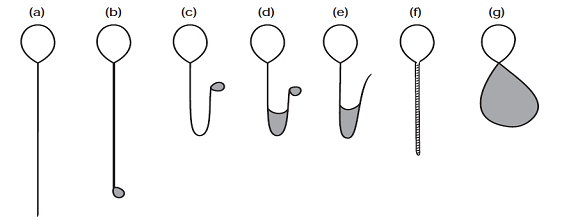
Hình 1: những thay đổi của đuôi tinh trùng trong điều kiện nhược trương. (a) không thay đổi. (b) – (g) những kiểu biến đổi khác nhau của tinh trùng
Khả năng tinh trùng trương phồng khi cho vào điều kiện nhược trương chứng tỏ chức năng màng nguyên vẹn, ví dụ khả năng màng cho phép vận chuyển nước để thiết lập tính cân bằng giữa môi trường bên trong tinh trùng và môi trường bên ngoài.
Khả năng trương phồng cao nhất trong dung dịch với áp suất là 150 mosmol.
Những mẫu xuất tinh thể hiện tỉ lệ khả năng xâm nhập vào trứng > 55% cho mối tương quan với khả năng trương phồng của tinh trùng cao hơn so với những mẫu chỉ có tỉ lệ xâm nhập vào trứng <55%. Thậm chí mỗi mẫu thể hiện <55% khả năng xâm nhập cũng có <55% tinh trùng trương phồng.
Ngược lại có rất ít mối tương quan giữa tỉ lệ tinh trùng trương phồng và hình thái học bình thường thể hiện ở những mẫu xuất tinh. Có mối tương quan cao hơn giữa tỉ lệ tinh trùng di động và tinh trùng trương phồng và giữa tỉ lệ tinh trùng trương phồng và tinh trùng không bắt màu eosin Y.
Nghiên cứu chứng minh hiệu quả của HOST so với các phương pháp khác đã được áp dụng
Hassan N.Sallam, Ashraf Farrag, Abdel-Fattah Agameya, Yehia El-Garem and Fathy Ezzeldin.“Sử dụng phản ứng nhược trương cho chọn lọc tinh trùng bất động thu từ tinh hoàn với những bệnh nhân chích ICSI: một nghiên cứu có đối chứng ngẫu nhiên.”
Nghiên cứu có đối chứng ngẫu nhiên để so sánh sử dụng test phản ứng nhược trương (50% môi trường nuôi cấy và 50% nước Milli-Q) với những tinh trùng lựa chọn trên cơ sở hình thái học của chúng.
Kết quả cho tỉ lệ thụ tinh cao hơn một cách có ý nghĩa trong nhóm HOST (43.6) so với nhóm không dùng HOST (28.2) (OR: 2.494; với khoảng tin cậy 95%: 1.606-3.872). Tỉ lệ có thai và tỉ lệ thai diễn tiến cũng cao hơn trong nhóm có HOST (27.3% so với 20.5% và 5.7% so với 2.9%) (OR 6.188, 95% CI 1.282–29.860; và OR 8.743, 95% CI 1.050–72.783).
Sử dụng HOST cho chọn lọc tinh trùng sống từ những tinh trùng bất động thu từ tinh hoàn cho những kết quả sau ICSI như tỉ lệ thụ tinh, tỉ lệ có thai và thai diễn tiến đều cao hơn phương pháp lựa chọn theo hình thái.
Nghiên cứu so sánh các dung dịch nhược trương sử dụng trong test HOS
G.Verheyen1, H.Joris, K.Crits, Z.Nagy, H.Tournaye and A.Van Steirteghem. “So sánh những dung dịch nhược trương gây trương phồng trong chọn lọc tinh trùng sống cho chích tinh trùng vào màng bào tương trứng”.
Ba dung dịch nhược trương được sử dụng trong nghiên cứu này là:
A. Dung dịch Jeyendran ((Jeyendran et al., 1984)- 7.35 g sodium citrate (Na3C6H5O7.2H2O)
- 13.51 g fructose
- 1 lít milli-Q water
Áp suất đo được là 155 mosmol/kg (Osmomat 030 Gonotec; Van Hopplynus, Brussels, Belgium).
B. Dung dịch gồm một nửa là nước milli-Q, một nửa là môi trường Earle chứa 0.48% HEPES và 1% HSA (áp suất là 285 mosmol/kg), kết quả cho áp suất cuối cùng là 139 mosmol/kg.
C. Nước milli-Q
Tỉ lệ cao nhất của tinh trùng bị trương phồng/tinh trùng không bị trương phồng ở thời điểm sau 5’ ủ và không có sự tăng lên nào từ 5-30 phút. Ủ trong nước (môi trường C) gây hại cho tinh trùng.
Tỉ lệ phần trăm của quá trình trương phồng thì cao hơn một hằng số so với tỉ lệ của những tinh trùng không bị nhuộm eosin Y (do đánh giá quá mức tinh trùng phản ứng dương khi tinh trùng có đuôi tạo thành góc tù).
Ủ in-vitro của tinh trùng sau khi cho vào môi trường nhược trương tác động một cách mạnh mẽ lên khả năng sống của tinh trùng, nhưng tác động này ít rõ ràng trong môi trường B.
Quá trình ủ tinh trùng vào trong ba môi trường nhược trương cho kết quả đáng so sánh về tỉ lệ phần trăm trương phồng, độ di động và khả năng sống của những tinh trùng sau khi dự trữ trong môi trường đẳng trương thể hiện khác biệt rõ ràng, và gần như rõ ràng khi sử dụng nước. Năm 1991, Lomeo và Giambersio miêu tả sử dụng nước tinh khiết như là môi trường nhược trương cho test chẩn đoán môi trường đáng tin cậy hơn môi trường Jeyendran, sau đó đã được xác nhận bởi Fuse và cộng sự (1993).
Tuy nhiên với những kết quả hiện tại tỉ lệ trương phồng khi sử dụng nước thì không thích hợp bằng những môi trường khác trong phân biệt tinh trùng sống chết để sử dụng cho ICSI. Điều kiện nhược trương lớn sau khi kết hợp nước và tinh trùng theo tỉ lệ 1:10 gây những stress về áp suất. Thể tích lớn của nước khi vào trong tế bào dẫn đến quá trình thủy phân màng tế bào và gây chết tế bào, thậm chí khoảng thời gian ủ là rất ngắn 10 giây. Điều này đã loại trừ khả năng dùng nước như là môi trường nhược trương để phân biệt tế bào sống cho ICSI.
Ủ 10-15 phút hoặc trong môi trường Jeyendran hoặc là trong môi trường với 50% môi trường/50% nước có tác động âm tính trên độ di động và khả năng sống sau 2 và 24h ủ trong môi trường đẳng trương.
Tuy nhiên khả năng sống thể hiện cao hơn khi ủ trong dung dịch B hơn là trong dung dịch A ở cả hai thời điểm. Chất lượng của tinh trùng khi ủ trong dung dịch B tốt hơn một cách hằng định khi ủ trong dung dịch A, có thể được giải thích bởi thành phần bên trong dung dịch B. Dung dịch B chứa toàn bộ thành phần đòi hỏi cho quá trình ủ tinh trùng tốt nhất trong khi dung dịch Jeyendran chỉ chứa fructose và sodium citrate.
Mặc dù còn những tranh cãi rằng khả năng sống sót và độ di động bị tác động khi ủ trong dung dịch nhược trương, điều này không nhất thiết chứng tỏ chức năng tinh trùng bị giảm sau khi chích vào trong trứng. Sử dụng tinh trùng chọn lựa bằng HOST cho ICSI trong bất kì trường hợp nào cũng có thể không hoàn toàn an toàn và hiệu quả thì rõ ràng thấp so với tinh trùng di động bình thường, thể hiện bằng tỉ lệ thụ tinh thấp 43% như Casper đã nghiên cứu vào năm 1996. Nói cách khác, thời gian ủ trong dung dịch nhược trương có thể bị giảm một cách đáng kể. Ủ trong 1h trong dung dịch nhược trương, như trong lời khuyên của Jeyendran 1984, và chỉ trong 10-15 phút như nghiên cứu hiện tại dường như vẫn quá lâu. Quá trình trương phồng của tinh trùng không thay đổi sau hơn 5 phút ủ ở bất kì dung dịch nhược trương nào. Hơn thế nữa, hút tinh trùng đơn lẻ bằng kim chích và cho vào vi giọt chứa dung dịch nhược trương cho kết quả trương phồng chỉ sau 10 giây, sau đó tinh trùng được đưa vào giọt mới của môi trường đẳng trương để thiết lập lại điều kiện sinh lí. Tỉ lệ trương phồng thực hiện thao tác với từng tinh trùng (3 mẫu; 50 tinh trùng/mẫu) tương tự với tỉ lệ phần trăm trương phồng được quan sát thấy trong quy trình ủ cổ điển. Những tác động không gây hại trên độ di động và sức sống trong thời gian dài thấy trong những nghiên cứu hiện tại có thể được giảm bằng cách ủ trong thời gian ngắn (10 giây), nhưng điều này cần những nghiên cứu xa hơn. Trong một nghiên cứu cận lâm sàng, trứng giai đoạn tế bào mầm IVM có thể được chích bằng tinh trùng được chọn lựa bằng dung dịch Jeyendran hay dung dịch 50% môi trường: 50% nước, để kiểm tra bất kì những ích lợi về tỉ lệ thụ tinh và tỉ lệ phân cắt.
Tuy nhiên có thể gom lại những dữ kiện về dung dịch chứa 50% môi trường: 50% nước cất thì thích hợp hơn trong chọn lựa tinh trùng để chích trong trường hợp bất động hoàn toàn. Tuy nhiên không rõ ràng liệu có những vấn đề của những trường hợp bất động hoàn toàn có thể được khắc phục bằng phương pháp này để chọn lựa tinh trùng sống. Vào ngày ICSI, mẫu tinh trùng của bệnh nhân có bất động hoàn toàn, chọn lựa bằng HOST tinh trùng sống có thể thành công và TESE có thể được tránh. Trong những trường hợp tinh trùng bất động hoàn toàn do những tổn hại bên trong cấu trúc, còn xa để chắc chắn rằng sử dụng HOST sẽ dẫn đến kết quả thụ tinh bình thường và phân cắt bình thường. Những tổn hại của trung thể thường được thấy trong những tinh trùng bất động hơn là trong những tinh trùng di động (Sathananthan, 1994). Nếu thụ tinh xuất hiện sau khi chích tinh trùng bất động, khả năng có những tổn hại trong thoi vô sắc dẫn đến sự phát triển của phôi kém, chậm phát triển hay bị dừng lại (Sathananthan và cộng sự, 1996; Van Blerkom, 1996). Giả thuyết này cần những nghiên cứu xa hơn.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Những cặp vợ chồng thực hiện thụ tinh trong ống nghiệm với mẫu tinh trùng bất động 100% (hoặc gần 100%). Nghiên cứu ghi nhận kết quả trên tổng cộng 14 chu kỳ được thực hiện từ tháng 6/2011 đến tháng 4/2012 tại trung tâm IVF – khoa Hiếm Muộn, BV Hùng Vương, trong đó có 1 chu kỳ sử dụng mẫu tinh trùng xuất tinh, 3 chu kỳ sử dụng mẫu tinh trùng tươi thu nhận từ phẫu thuật và 10 chu kỳ sử dụng mẫu tinh trùng trữ đông sau phẫu thuật.
Lọc rửa tinh trùng
Đối với những mẫu tinh trùng thu nhận từ mô tinh hoàn, các mẫu mô sẽ được xé nhỏ để tìm tinh trùng. Khi xác định có tinh trùng trong mẫu thì tiến hành xử lý mẫu bằng cách hút dịch mô cho vào ống tube nhỏ 5ml và gạn bỏ các mảnh mô nhỏ rồi tiến hành lọc rửa trên dịch mô thu nhận được. Đối với những mẫu tinh trùng thu nhận từ mào tinh hoàn, thu nhận dịch mào tinh để tiến hành lọc rửa. Phương pháp lọc rửa được sử dụng là phương pháp thang nồng độ (sử dụng môi trường Sil Select – FertiPro), sau đó được rửa lại bằng môi trường Sperm Preparation (FertiCult). Mẫu tinh trùng sau khi chuẩn bị được giữ trong tủ ấm 1-2h trước khi sử dụng.
Tiêm tinh trùng vào bào tương trứng
Môi trường được sử dụng cho phép thử HOS là một hỗn hợp gồm 50% môi trường (GMops plus – Vitrolife) và 50% nước cất Milli – Q được hòa trộn hoàn toàn.
Đĩa petri 35mm để tiến hành ICSI được chuẩn bị bao gồm 6 giọt môi trường (chứa trứng), 1 giọt môi trường (chứa tinh trùng), 1 giọt PVP (Polyvinylpyrrolidone) và 1 giọt môi trường HOS.
Dùng kim ICSI lựa chọn tinh trùng từ giọt môi trường chứa tinh trùng và cho vào giọt HOS trong vòng dưới 10s. Đánh giá độ xoắn đuôi của tinh trùng rồi hút tinh trùng đưa sang giọt PVP trước khi tiêm vào trứng. Chúng tôi ghi nhận 3 dạng xoắn đuôi chính của tinh trùng trong giọt môi trường HOS như sau:
 |
 |
 |
| (1): TT xoắn đuôi ở đoạn xa (cuối đuôi) | (2): TT xoắn đuôi ở đoạn giữa | (3): TT xoắn đuôi ở đoạn gần cổ |
Sau khi ICSI, trứng được nuôi cấy trong các giọt môi trường GIVF plus (Vitrolife). Thực hiện kiểm tra thụ tinh vào thời điểm 16 – 18 giờ sau đó bằng cách kiểm tra sự xuất hiện của 2 tiền nhân (PN). Phôi được đánh giá vào ngày 3 sau khi nuôi cấy. Phôi tại thời điểm 66 – 68 giờ được đánh giá là phôi tốt khi có đầy đủ các đặc điểm sau: có từ 6 – 8 phôi bào, các phôi bào có kích thước đồng đều và tỉ lệ phân mảnh bào tương nhỏ hơn 10% thể tích của phôi.
KẾT QUẢ
Bảng 1: Một số đặc điểm nhóm bệnh nhân thực hiện ICSI kết hợp HOS
|
Số bệnh nhân |
14 |
|
Tuổi chồng |
34.58 ± 4.96 |
|
Tuổi vợ |
26.67 ± 3.12 |
|
Thời gian vô sinh |
3.36 ± 1.33 |
Bảng 2: Đánh giá kết quả ICSI của 3 dạng xoắn đuôi tinh trùng.
|
|
Dạng (1) |
Dạng (2) |
Dạng (3) |
|
Số trứng ICSI |
92 |
44 |
25 |
|
Tỷ lệ thụ tinh (%) |
37 |
61.4 |
52.0 |
|
Tỷ lệ phôi phân chia (%) |
91.2 |
96.3 |
100 |
|
Tỷ lệ phôi hữu dụng (%) |
74.2 |
76.9 |
69.2 |
|
Tỷ lệ phôi tốt (%) |
45.2 |
57.7 |
61.5 |
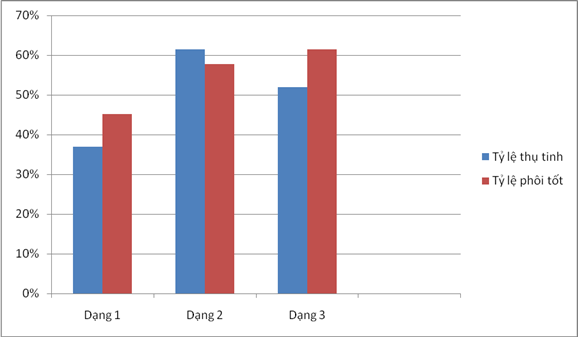
Biểu đồ 1: so sánh tỷ lệ thụ tinh và tỷ lệ phôi tốt giữa 3 dạng trương phồng
BÀN LUẬN
Những thuận lợi và khó khăn khi kết hợp HOST với quy trình ICSI tại khoa
Thuận lợi
- Thêm một biện pháp chọn lựa tinh trùng sống cho những trường hợp tinh trùng bất động 100%.
- Hứa hẹn cho tỉ lệ thụ tinh, tỉ lệ phôi cao hơn so với các phương pháp lựa chọn ngẫu nhiên tinh trùng bằng hình thái học hay phương pháp tác động cơ học.
- Chuẩn bị môi trường đơn giản, ít tốn kém.
Khó khăn
- Dè dặt những trường hợp tinh trùng bất động hoàn toàn nhưng đa số có đuôi quá ngắn. Vì đuôi tinh trùng ngắn, khi bất động tinh trùng, có thể làm ảnh hưởng đến vùng cổ, vị trí của trung thể tinh trùng, giảm tỉ lệ thụ tinh, tỉ lệ phôi.
- Do tỉ lệ dương tính giả đã được chứng minh là khá cao, và quy trình cần có một thời gian để ổn định và điều chỉnh cho phù hợp với điều kiện trong labo.
Qua thực hiện HOS test, chúng tôi ghi nhận có 3 dạng trương phồng chính như các hình vẽ trên. Bảng 2 cho kết quả đánh giá về các thông số của ICSI liên quan đến 3 dạng xoắn đuôi của tinh trùng. Qua đó, tỷ lệ thụ tinh giữa dạng 1 và 2 dạng còn lại (dạng 2,3) có sự khác biệt rõ rệt và tỷ lệ phôi tốt ở nhóm tinh trùng dạng 3 và dạng 2 cao hơn hẳn so với tinh trùng dạng 1. Đây là nghiên cứu đầu tiên đánh giá hiệu quả của ICSI với các dạng trương phồng khác nhau của tinh trùng. Cũng có một nghiên cứu của tác giả F.Bassiri và cộng sự nói đến các dạng trương phồng khác nhau của tinh trùng với mối tương quan về sự phân mảnh DNA, khiếm khuyết protamin, về hình dạng và khả năng hoạt hóa, chuyển hóa của màng tinh trùng cũng như sự thâm nhập của tinh trùng vào trứng cho thấy dạng 1 là dạng được ưu tiên để lựa chọn khi làm ICSI, rồi đến dạng 2, sau cùng là dạng 3. Nhưng có một số điểm cần lưu ý trong nghiên cứu này: một là nghiên cứu này dựa trên những mẫu tinh trùng ngẫu nhiên có di động bình thường, hai là tác giả chỉ khảo sát để so sánh mối tương quan giữa các dạng trương phồng khác nhau của tinh trùng với những yếu tố nói trên, hoàn toàn không có thực hiện ICSI trên những tinh trùng này và do vậy, không thể đánh giá hiệu quả thực sự của ICSI. Ngược lại, những mẫu tinh trùng chúng tôi thực hiện là những mẫu tinh trùng rất xấu, tinh trùng bất động 100% (hoặc gần 100%) từ những mẫu tinh trùng chủ yếu từ phẫu thuật và sau trữ đông nên phải chăng có sự kết luận không giống nhau về hiệu quả của ICSI với các dạng trương phồng khác nhau của tinh trùng? Và số liệu chúng tôi thu thập được cũng còn ít để có thể có một kết luận chính xác.
KẾT LUẬN
Việc lựa chọn dạng trương phồng của tinh trùng có ảnh hưởng đến kết quả của kỹ thuật ICSI, cụ thể theo nghiên cứu ban đầu của chúng tôi, dạng trương phồng (2) và (3) làm cải thiện đáng kể tỷ lệ thụ tinh cũng như tỷ lệ phôi tốt sau kỹ thuật ICSI. Từ đó cho thấy khả năng đây là những dạng trương phồng tối ưu khi lựa chọn tinh trùng cho kỹ thuật ICSI kết hợp với HOS. Tuy nhiên, cần có những nghiên cứu với cỡ mẫu lớn hơn để có một kết luận chính xác.
Tài liệu tham khảo
1. Hassan N.Sallam, Ashraf Farrag, Abdel-Fattah Agameya, Yehia El-Garem and Fathy Ezzeldin. The use of the modified hypo-osmotic swelling test for the selection of immotile testicular spermatozoa in patients treated with ICSI: a randomized controlled study.
2. Chatzimeletiou K, Morrison EE, Prapas N, Prapas Y, Handyside AH. The centrosome and early embryogenesis: clinical insights. Reprod BioMed Online 2008; 16 : 485-91.
3. Sathananthan AH. Mitosis in the human embryo: the vital role of the sperm centrosome (centriole). Histol Histopatho1 1997; 12 : 827-56.
4. Schatten G. The centrosome and its mode of inheritance: the reduction of the centrosome during gametogenesis and its restoration during fertilization. Dev Biol 1994; 165:299-35.
5. Sathananthan AH, Ratnam SS, Ng SC, Tarin JJ, Gianaroli L, Trounson A. The sperm centriole: its inheritance, replication and perpetuation in early human embryos. Hum Reprod 1996; 11 : 345-56.
6. de Kretser DM, Kerr JB. The cytology of the testis. In: Knobil E, Neill JD, editors. The physiology, of reproduction. 2nd ed. New York: Raven Press; 1994. p. 1177-290.
7. A. Henry Sathananthan. “Human centriole: origin and how it impacts infertilization, embryologenesis, infertility and cloning”. Indian Journal of Medical Research, April 2009.
8. Sathananthan AH. Inheritance of paternal centrioles and male infertility. XIIIth World Congress of Obstetrics and Gynaecology, Singapore. 1991 ; Abstr. No. 1629.
9. Sathananthan AH, Ratnasooriya WD, de Silva PK, Menezes J. Characterization of human gamete centrosomes for assisted reproduction. J Anat Embryol 2001; 106 (Suppl 2) : 61-73.
10. Munne S. Chromosome abnormalities and their relationship to morphology and development of human embryos. Reprod Biomed Online 2006; 12 : 234-53.
11. G.Verheyen1, H.Joris, K.Crits, Z.Nagy, H.Tournaye and A.Van Steirteghem. “Comparison of different hypo-osmotic swelling solutions to select viable immotile spermatozoa for potential use in intracytoplasmic sperm injection”.Human Reproduction Update 1997, Vol. 3, No. 3 pp. 195–203
12. WHO laboratory manual for the examination and processing of human semen. Fifth Edition.
13. Sz. Mátyás, I. Balogh, K. Rajczy, A. Bernard, Gy. Papp, I. Gáti, S.G. Kaali. Experiences with hypoosmotic swelling test.
14. F. Bassiri1, M. Tavalaee1, A.H. Shiravi, S. Mansouri,and M.H. Nasr-Esfahani. “Is there an association between HOST grades and sperm quality?”. Human Reproduction, Vol.0, No.0 pp. 1–8, 2012.
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








